深圳先进院等在纳米载药系统治疗骨髓炎领域获得新进展
发布时间:2020-10-26 来源:医药所退行中心
近日,中国科学院深圳先进技术研究院医药所人体组织与器官退行性研究中心王国成副研究员团队与海军军医大学第一附属医院许硕贵教授团队,在纳米载药系统治疗骨髓炎领域获得新进展。相关研究成果以Silicon incorporation into hydroxyapatite nanocarrier counteracts the side effects of vancomycin for efficient chronic osteomyelitis treatment为题发表在化学工程与技术学科的权威刊物Chemical Engineering Journal(https://doi.org/10.1016/j.cej.2020.126821,影响因子10.652)上。本研究中深圳先进院助理研究员徐正江、海军军医大学第一附属医院夏琰博士和周潘宇博士为并列第一作者。
慢性骨髓炎是指由细菌所引起的并伴有骨质破坏的慢性炎症过程,常继发于急性骨髓炎,多由于开放性创伤、多次骨折手术或细菌血源性播散所引起,临床表现为患肢局部破溃流脓、组织水肿、死骨形成以及寒战、高热、甚至感染性休克等全身症状,一直是临床骨科医生所面临的最为棘手的问题之一。目前,临床治疗慢性骨髓炎的方法是通过手术彻底清除病灶(死骨和炎症组织)并结合长达4至6周全身抗生素治疗。但是长期全身大剂量使用抗生素的副作用多,可引起如耳毒症、肝肾毒性、肠胃相关并发症、影响骨骼发育等并发症,且很难达到并维持骨髓炎感染部位所需的有效血药浓度。
通过药物载体实现抗生素局部递送不仅可以避免全身抗生素治疗带来的副作用,且可实现抗生素在感染部位的持续高浓度释放。然而局部高浓度的抗生素虽能有效地控制感染,但却会对周围组织产生明显毒副作用,甚至干扰新骨形成。因此,理想的抗生素载体应具有双重功能,即能可控/持续释放抗生素来消除感染,同时具有高骨诱导活性以促进骨再生。目前新抗生素载体的研发主要集中在优化其载药量和释放特性,而在很大程度上忽视了“如何抵消高浓度抗生素对骨再生的负面影响”这一问题。
生物活性离子对骨再生的促进作用被广泛证实,其中硅离子在血管再生和骨再生方面的作用尤为明显。在前期工作中,王国成研究团队开发了多种含Si的骨修复材料,均具有较好的生物活性(Biomaterials, 2020, 232, 119645; ACS Appl. Mater. Interfaces, 2015, 7, 23412;Biomaterials, 2013, 34, 13, 3184; Colloids and Surf. B, 2019, 176, 420)。基于此,团队提出如下假设:生物活性Si离子有可能在抵抗抗生素的负面作用方面具有一定效果。
为了验证本假说,本研究采用原位包裹法将一定厚度的介孔生物活性玻璃(MBG)包裹到纳米羟基磷灰石(HAp)载体表面,通过负载抗生素(万古霉素)构建了含Si的纳米药物递送系统。研究证明较单纯的纳米HAp而言,MBG的引入可提高药物装载量并优化其缓释功能。体外细胞实验结果证明,MBG包裹纳米载药系统较HAp载药组能够更好地促进成骨细胞增殖和成骨分化。慢性骨髓炎动物模型实验结果证明较单纯的HAp载药组,MBG包裹的载药系统可以抑制感染,同时因Si离子的引入能减少万古霉素对细胞的副作用,从而显著提高感染部位的骨再生能力。团队通过在含有万古霉素的培养基中加入Si离子进行细胞培养实验,进一步证实了Si离子可缓解万古霉素对成骨细胞造成的负面作用。目前,研究团队针对相关的分子机制展开研究。
该项目获得国家重点研发计划、国家自然基金、广东省科学技术计划、深圳市科技研究基金和上海市青年科技英才扬帆计划等项目资助。
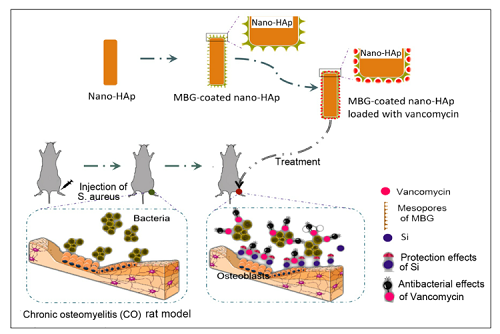
介孔生物活性玻璃包裹纳米羟基磷灰石负载万古霉素治疗慢性骨髓炎的示意图
